Вначале надо вспомнить, что существующие ныне формы жизни на нашей планете обязаны кислороду, который был создан самой жизнью, а именно фотосинтезом. Количество кислорода не было постоянным. Были эпохи, когда, например, около 1500 млн. лет назад, кислорода было много и железо, содержащееся в земной коре окисляясь, формировало залежи известных железных руд с участием воды (гидрооксиды железа). Сегодня горизонты залежей этого возраста дают основу развития мировой черной металлургии. А в современных осадках на дне океанов в настоящее время образуются оксидные руды железомарганцевых конкреций. Таким образом, железо на планете выступало (и выступает) регулятором количества кислорода в атмосфере и воде.
С появлением кислорода в атмосфере Земли начал формироваться озоновый слой. Он образовался в результате облучения солнцем народившейся атмосферы, содержащей кислород, который и защитил поверхность Земли от губительной для живого солнечной радиации. С созданием озонового слоя на уровне современной толщины в атмосфере Земли, в ордовике (около 460 млн. лет назад) жизнь заселила сушу, а уже в девоне (примерно через 80 – 100 млн. лет) возникли бассейны угленакопления.
С тех пор и по настоящее время озоновый слой вряд ли испытывал значительные колебания в атмосфере Земли, поскольку нет ни одной эры и эпохи, в которой бы не существовала жизнь. До тех пор, пока на Земле существует жизнь, в том числе фотосинтезирующие организмы, до тех пор и будет соблюдаться баланс поступления кислорода в атмосферу и его вывод из неё под влиянием окислительных процессов.
Следует напомнить, что в условиях медленного захоронения отмерших живых организмов на их разложение требуется примерно столько же кислорода, сколько его создается фотосинтезом. А также заметить, что в создание основной массы живого вещества участвуют микроорганизмы – бактерии. Но зачастую попытки оценки биомассы, участвующей в круговороте кислорода и углекислого газа, не могут количественно учесть долю микроорганизмов, чтобы аргументировано обосновать роль живого вещества в формировании не только газового, но и водного баланса на Земле.
Немножко теории
Озон (от древнегреческого – ὄζω – пахну) – аллотропная модификация кислорода состоящая из трёх атомов кислорода – О3. Представляет собой взрывчатый газ синего цвета с резким характерным запахом.
Аллотропия (от греч. állos — другой, греч. trópos — поворот, свойство) — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам, т. н. аллотропических модификаций или аллотропических форм. Например, кислород имеет три состояния: О, О2, и О3.
Озон – один из наиболее сильных окислителей (гораздо сильнее обычного кислорода). Он окисляет все металлы (за исключением золота и элементов платиновой группы), а также большинство других элементов. При действии на некоторые неорганические и органические соединения образует озониды.
Озон образуется по обратимой реакции:
3O2 + 68 ккал (285 кДж) ←→ 2O3
Механизм образования, а также расходования озона, был предложен С. Чэпманом в 1930. Схема реакции образования озона выглядит следующим образом:
О2 + hν → 2О
О2 + O → О3
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения Солнца с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
О3 + hν → О2 + О
О3 + O → 2О2
Озон также образуется в реакциях, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. д. В промышленности его получают из воздуха или кислорода в озонаторах действием тихого электрического разряда. Сжижается O3 легче, чем O2, и потому их легко разделить. Медицинский озон для озонотерапии получают только из чистого кислорода.
Молекула О3 неустойчива и самопроизвольно превращается в O2 с выделением тепла. При небольших концентрациях и без посторонних примесей озон разлагается медленно, при больших концентрациях разлагается со взрывом. Нагревание и контакт озона с ничтожными количествами органических веществ, некоторых металлов или их оксидов резко ускоряет превращение. Наоборот, присутствие небольших количеств HNO3 стабилизирует озон, а в сосудах из стекла, некоторых пластмасс или чистых металлов озон при − 78ºС практически не разлагается. Поскольку на высоте 25 км, где сосредоточено основное количество атмосферного озона, температура воздуха находится вблизи - 78ºС, то его самопроизвольное разложение на этой высоте не происходит.
Озоновый слой
Озоновый слой в атмосфере Земли впервые выделили французские физики Шарль Фабри и Анри Буиссон. В 1913 году с помощью спектроскопических измерений ультрафиолетового излучения им удалось доказать существование озона в отдалённых от Земли слоях атмосферы – стратосфере.
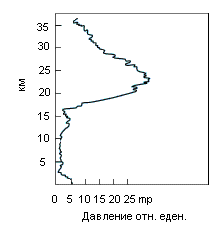
|
Он формируется в стратосфере на высоте от 12 до 50 км, рис. 5. Максимум концентрации озонового слоя (максимальная его плотность) толщиной всего в 500 м достигается на высоте 25 км. Наибольшая часть в объёме атмосферы концентрация озона достигается на высоте до 40 км. На высотах 12 – 50 км под влиянием ультрафиолетового излучения Солнца кислород (О2) ионизируется, приобретая третий атом кислорода и преобразуется в озон (О3). Необходимо подчеркнуть, что защитными свойствами от радиоактивного облучения поверхности Земли обладает только озон. Ни одна другая аллотропная модификация не обладает этим свойством. Относительно высокая концентрация озона (около 8 мл/м3) абсорбирует опасные ультрафиолетовые лучи и защищает всё живущие на суше от губительного излучения. Более того, если бы не озоновый слой, то жизнь не смогла бы вообще выбраться из океанов и высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы. Если бы можно было извлечь весь озон, находящийся в атмосфере, и сжать под нормальным давлением, то в результате вышел бы слой, покрывающий поверхность Земли толщиной всего 3 мм. Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км.
Реакции, способствующие разрушению озона в атмосфере Земли
Кроме реакций, входящих в механизм С.Чэпмана, известны другие реакции, изымающие озон из атмосферы Земли1. Эти реакции объединяют в несколько семейств. Главными из них является азотное, кислородное (из механизма Чэпмана), водородное и галогеновое семейство. Эти реакции представляют собой каталитические циклы:
Азотный цикл (NOx):
N2O + O(1D) → NO + NO
О3 + NO → NO2 + О2
NO2 + О → NO + О2
Водородный цикл (HOx):
Н2O + O → OH + OH
ОН + О3 → НО2 + О2
НО2 + О3 → ОН + 2О2
Хлорный цикл (ClOx):
CFCl3 + hν → CFCl2 + Cl
Cl + O3 → ClO + O2
ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств приведена в таблице 5.
Таблица 5
Доля в расходовании озона различных химических семейств2
| Давление, гПа | Химические семейства расходования озона | |||
|---|---|---|---|---|
| азотное | кислородное | водородное | галогеновое | |
| 1.31 | 0.10 | 0.26 | 0.41 | 0.21 |
| 3.78 | 0.50 | 0.14 | 0.11 | 0.25 |
| 8.93 | 0.68 | 0.11 | 0.08 | 0.13 |
| 21.9 | 0.46 | 0.12 | 0.19 | 0.20 |
| 55.8 | 0.12 | 0.03 | 0.48 | 0.14 |
Реакции, ведущие к разрушению озона в атмосфере Земли, связаны с совокупностью естественных и антропогенных причин, включая отсутствие солнечного воздействия на верхние слои атмосферы в течение полярной зимы на полюсах Земли. Там возникает особо устойчивый полярный вихрь, препятствующий проникновению озона из приполярных широт и образованию полярных стратосферных облаков, поверхность частиц которых выступает катализаторами реакции распада озона.
Условия, способствующие разрушению озона, таким образом, присущи в основном Антарктики и Арктики. В пределах Арктики формирующийся полярный вихрь намного слабее антарктического в виду отсутствия континентальной поверхности. Поэтому здесь температура выше, чем в Антарктике, а полярные стратосферные облака менее распространены.
Химически активные молекулы озона вступают в реакции с неорганическими и органическими соединениями. В качестве основных веществ-разрушителей озона выступают водород, кислород, хлор. А также неорганические соединения: хлороводород, моноксид азота; органические соединения: метан, фторхлор- и фторбромфреоны, которые являются источником хлора и брома. В отличие от последних гидрофторфреоны, распадающиеся до атомов фтора, быстро реагируют с водой, образуя устойчивое соединение фтороводорода. Таким образом, фтор не участвует в реакциях распада озона, как и йодсодержащие органические вещества. Фтор и йод по большей части расходуются ещё в тропосфере и не достигает стратосферного слоя, где концентрируется основное количество озона. То есть фреоны из-за значительной их массы не способны достигать стратосферы.
Существует проблема количественной оценки источников соединений, участвующих в разрушении озонового слоя. Такими источниками являются соединения, образующиеся в результате хозяйственной деятельности человека (антропогенные источники) и естественные, например, природные источники современных действующих вулканов, галогены океанов.
То есть вмешательство человека увеличивает вклад хлорного цикла. И при имевшейся тенденции к увеличению производства фреонов до вступления в действие Монреальского протокола (10 % в год) от 30 до 50 % общих потерь озона в 2050 году обуславливалось бы воздействием фреонов3. Считается, что до антропогенной добавки процессы образования озона и его разрушения находились в равновесии. Но фреоны, выбрасываемые по ходу возрастания человеческой деятельности, сместили это равновесие в сторону уменьшения концентрации озона.
Участие галогенов океана считается доминирующим среди естественных источников соединений, участвующих в разрушении озонового слоя. Считается, что вклад природных источников в общий баланс галогенов, участвующих в разрушении озонового слоя незначителен. В силу того, что они не достигают стратосферы, поскольку являются водорастворимыми (например, хлорид-ионы и хлороводород) и вымываются из атмосферы, выпадая в виде дождей на землю.
Роль вулканической деятельности недооценивается, так как считается, что в процессе извержения недостаточно выделяется соединений, разрушающий озон, которые могут проникнуть в стратосферный слой насыщенный озоном. Однако при извержении вулкана Пинатубо в июне 1991 г сопровождалось ощутимым падением уровня озона. Как считают специалисты, это понижение уровня сопровождалось не за счёт высвобождаемых галогенов, а за счёт образования большой массы сернокислых аэрозолей, поверхность которых выступала в качестве катализаторов реакции разрушения озона. Но дело в том, что эти аэрозоли в стратосфере присутствовали в течение около трех лет. То есть длительное время участвовали в реакциях разрушения озонового слоя. К тому же данные вулканологов подтверждают наличие в составе выбросов вулканов фреонов таких, как фреон-11, фреон-12, фреон-111.
Пинатубо — вулкан, расположенный на филиппинском острове Лусон в 93 км к северо-западу от столицы Манилы и 26 км к западу от города Анхелес. Его высота сегодня составляет 1486 метров, а до крупного извержения в 1991 она составляла 1745 м. До этого извержения вулкан считался потухшим. Последнее извержение Пинатубо произошло 12 июня 1991, впервые за 611 лет. Оно было одним из самых крупных извержений вулканов в XX веке. Благодаря прогнозу извержения десятки тысяч людей были эвакуированы с прилежащих территорий. Но, несмотря на это, все же от извержения и его последствий погибло 875 человек. Кроме этого окрестности вулкана были опустошены пирокластическими потоками, слоями пепла и лахарами.
Последствия извержения Пинатубо были ощутимы по всему миру. Оно привело к самому мощному выбросу аэрозолей в стратосферу со времён извержения вулкана Кракатау в 1883 г. На протяжении следующих месяцев в атмосфере наблюдался глобальный слой сернокислотного тумана. Было зарегистрировано падение температуры на 0,5°С и чрезмерное сокращение озонового слоя.
Ссылки
-
К. Ларин. Химия озонового слоя и жизнь на Земле.// Химия и жизнь - XXI век. — 2000. — № 7. ↩
-
Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000 ↩
-
National Academy of Sciences Галогенуглеводороды: воздействие на стратосферный озон = Halocarbons: Effects on Stratospheric Ozone. — 1976. ↩
